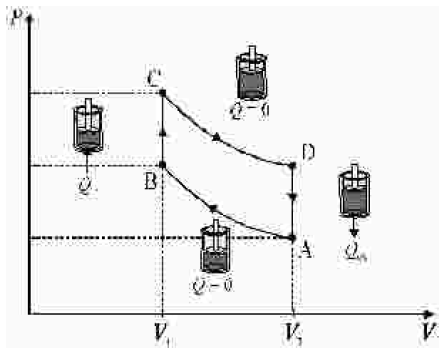
As leis da termodinâmica aplicam-se ao estudo e à caracterização de motores a combustão. O funcionamento de um motor ideal baseia-se no regime denominado ciclo de Carnot. Apesar disso, a maioria dos motores automotivos, que é de combustão interna, a gasolina e(ou) a álcool, trabalha em regime denominado ciclo Otto. Neste caso, na câmara de combustão do motor, uma mistura formada por vapor de combustível e ar é comprimida e inflamada por uma centelha produzida pelas velas. Os gases produzidos expandem-se realizando trabalho sendo, em seguida, eliminados pelo escapamento, o que completa um ciclo que se repete. A figura acima representa um modelo do comportamento da pressão em função do volume da câmara de combustão. O ciclo é constituído de quatro transformações alternadas — duas adiabáticas e duas isométricas — e, por isso, os motores são classificados como de quatro tempos. As quatro etapas, representadas na figura acima, são as seguintes:
I de A para B (admissão e compressão): a mistura de vapor de combustível e ar entra na câmara de combustão (admissão) e é comprimida adiabaticamente (compressão);
II de B para C (ignição): o volume permanece constante e a mistura é aquecida. A pressão e a temperatura aumentam devido à centelha elétrica da vela que produz a ignição da mistura;
III de C para D (expansão): os gases expandem-se adiabaticamente realizando trabalho motor;
IV de D para A (descarga): tem-se um resfriamento isométrico e completa-se um ciclo.
No gráfico, V1 e V2 representam, respectivamente, os volumes mínimo e máximo da mistura na câmara de combustão. A razão \frac{V_2}{V_1} , chamada taxa de compressão, é igual a 8 para motores modernos a combustão interna. Suponha que, nas transformações adiabáticas, os gases se comportam idealmente e que a pressão e o volume se relacionam pela lei de Poisson, segundo a qual PV^λ = constante, em que λ = \frac{C_P}{C_V} , e CP e CV representam o calor ã molar a pressão constante e o calor molar a volume constante, respectivamente. Para gases ideais, CP = CV + R, em que R é a constante universal dos gases ideais.